Николай Беспалов: Вступление в ВТО… Переход на GMP…
Print
17 Мая 2013
Новости GMP
Всем компаниям, занятым системой лекарственного обеспечения в России хотелось бы перейти на работу в новых условиях с наименьшими потерями для бизнеса.
Переговоры о вступлении России в ВТО велись на протяжении 19 лет, и наконец-то 22 августа 2012 г. этот процесс завершился – вступил в силу протокол о присоединении России к соглашению об учреждении ВТО и наша страна стала наконец-то 156-м участником этой организации.
До этого момента тема вступления в ВТО не раз поднималась и попадала под пристальное внимание широкой общественности. Кто-то сетовал, что до сих пор не вступили, кто-то сетовал за то, что вступать вообще не надо, иначе многим отраслям экономики будет нанесён непоправимый удар и т.д. В общем можно было услышать полный набор «страшилок» в духе конца света.
На самом деле утром 23 августа абсолютно ничего для экономики в целом и для фармацевтического рынка в частности не изменилось. Для фармацевтического рынка России не произошло каких-то кардинальных перемен и спустя полгода с момента вступления России в ВТО, хотя правда заключается в том, что изменения в российской экономике и системе регулирования рынка начались задолго до самого факта присоединения к ВТО. Достаточно сказать, что за последние 12 лет проводилась огромная работа по реформированию законодательной базы в России, с целью гармонизации её с требованиями ВТО. За это время было принято более 30 различных законодательных актов. В отношении фармацевтического рынка в частности появились такие важнейшие документы как: «Закон об обращении ЛС», «Закон об основах охраны здоровья граждан» и «Закон об обязательном медицинском страховании». Все мы уже несколько лет выстраиваем работу, руководствуясь именно на них. При этом необходимо отметить, что по суммарному объёму российский фармацевтический входит в число наиболее крупных в мире, обгоняя, например, такие страны как: Италия, Великобритания, Испания и т.д. По динамике же развития в мире вообще есть очень не много стран, которые могут сравниться с темпами роста рынка в нашей стране. По итогам 2012 г. российский фармрынок перешагнул своеобразный психологический рубеж и достиг объёма 25,3 млрд. USD в ценах конечного потребления (рис. 1). Динамика рынка при этом составила 10,6%, что значительно выше темпов развития рынка в 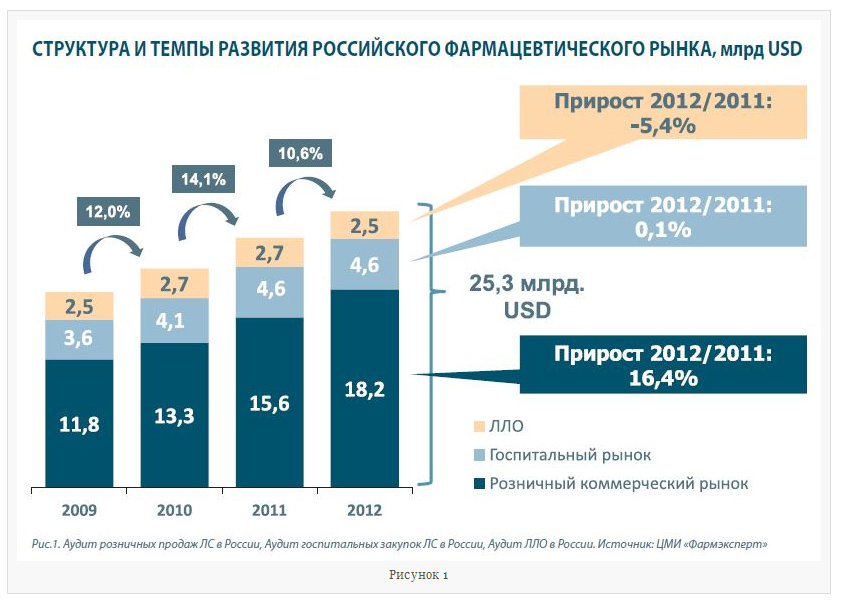 развитых странах, где очень высоким считается показатель прироста в 2-3%.
развитых странах, где очень высоким считается показатель прироста в 2-3%.
Наиболее крупным сегментом российского фармацевтического рынка в денежном выражении является розничный-коммерческий сегмент, по итогам года он занимает 18,2 млрд. USD. Этот же сегмент рынка демонстрирует наибольшие темпы роста – 16,4% в 2012 г. по сравнению с 2011 г. Основной вклад в развитие сегмента вносят следующие факторы: рост натурального потребления лекарственных препаратов (ЛП), переход на покупку более дорогих ЛП и инфляционный фактор – особенно в отношении тех ЛП, на которые не распространяется ценовое регулирование, а их в рознице абсолютное большинство – порядка 64%. Второй по абсолютному объёму рынка госпитальный сегмент – 4,6 млрд. USD, правда динамика по этому сегменту рынка практически отсутствует. Причин тому как минимум две. Во-первых, значительная пробуксовка программы модернизации здравоохранения, которая была рассчитана на 2011-2012 гг., но реализовывалась с отставанием от графика примерно на 40% (по данным Счётной палаты РФ). Во-вторых это активные процессы дженерикового замещения, которые имеют место в тех сегментах рынка, которые связаны с государственным финансированием. Третий по объёму сегмент – т.н. льготное лекарственное обеспечение, на него приходится порядка 2,5 млрд. USD, причём здесь отмечена отрицательная динамика на уровне -5,4%. Основная причина снижения объёмов всё те же активные процессы дженерикового замещения.
Безусловно, сам факт присоединения России к ВТО предполагает выполнение и других обязательств, о которых необходимо сказать отдельно. К тому же они способны оказать определённое влияние и на динамику дальнейшего развития российского рынка.
Прежде всего, в числе таких обязательств снижение размера таможенных пошлин на ЛП. Сейчас для большинства препаратов размер таможенного тарифа на территории ЕТП (России, Казахстана и Беларуси) составляет 10%, правда для отдельных видов ЛП он может колебаться от 0 (например, инсулин) до 15% (отдельные виды антибиотиков, витамины и др.). В рамках ВТО таможенная пошлина составляет от 5 до 6,5%, таким образом можно рассчитывать на некоторое снижение стоимости иностранных ЛП. Впрочем, снижение это, особенно учитывая тот факт, что оно будет проводиться не одномоментно, скорее всего, пройдёт незамеченным в связи с ростом стоимости транспортных расходов и других процедур, необходимых для обеспечения доступа ЛП на рынок.
Помимо этого серьёзные изменения ожидаются в отношении процедуры регистрации воспроизведённых ЛП на территории России. Так после регистрации оригинального препарата на протяжении 6 лет, компаниям, которые производят препараты-аналоги (т.н. дженерики), при регистрации будет запрещено ссылаться на данные клинических исследований оригинального продукта. Эта норма фактически предоставляет возможности производителям оригинальных ЛП продлять отдельные аспекты патентной защиты на свою продукцию, что будет сдерживать появление дженериков. Для российских производителей дженериков это будет означать увеличение времени вывода дженериков на рынок и удорожание этой процедуры, разумеется, оно скажется и на потребителях ЛП. Впрочем, хочется надеяться, что эта мера подстегнёт развитие потенциала российских компаний в отношении производства оригинальных ЛП, тем более, что такие возможности существуют. Все участники рынка хорошо знают такие ЛП как: Арбидол, Амиксин, Афобазол, Фенотропил, Кагоцел, Ингавирин, Циклоферон, Энтеросгель и др. Все эти препараты являются оригинальными разработками советских и российских учёных, все они успешны на российском рынке и за его пределами. И, кстати, вступление России в ВТО даёт ряд возможностей для российских производителей по выходу на зарубежные рынки.
Вообще исторически сложилось так, что наша страна практически не экспортировала готовые формы ЛП. Поэтому подавляющее количество компаний новой формации, которые начали активно производить свою продукцию уже после 90-х годов прошлого века, были вынуждены осваивать возможности экспорта с чистого листа. Прежде всего, конечно началось освоение рынков стран СНГ, как наиболее исторически и ментально близких, однако, за последние 5 лет география поставок существенно расширилась. Чаще всего за счёт стран Азии: Гонконг, Вьетнам, Китай; и в меньшей степени за счёт Европейских стран: Чехии, Словении, Болгарии и даже Германии. Впрочем, пока это скорее успехи отдельных компаний, чем какая-то серьёзная тенденция.
В этом смысле вступление России в ВТО должно дать возможности российским компаниям более активно работать на экспортном направлении. Это должно произойти в результате отмены действия ряда документов в отдельных странах – участницах ВТО, которые ограничивали свободный экспорт продукции из России. Правда, необходимо отметить, что процесс этот может растянуться на несколько лет, помимо этого есть другие серьёзные проблемы, в частности, связанные с необходимостью наличия GMP. Увы, отсутствие соответствующих сертификатов закрывает доступ на наиболее перспективные рынки для целого ряда российских компаний, да и строго говоря, мешает эффективному развитию внутрироссийского рынка.
Надо сказать, что российские компании пока проигрывают в конкурентной борьбе с иностранными предприятиями. Так, доля российских компаний на рынке в целом по итогам 2012 г. составляет в денежном выражении всего лишь 26,3% (рис 2.), при этом, правда, необходимо отметить существенную позитивную динамику – за минувший год доля российских компаний на рынке увеличилась практически на 1%. При этом, российская продукция доминирует на рыке в натуральном выражении, здесь на долю российских компаний 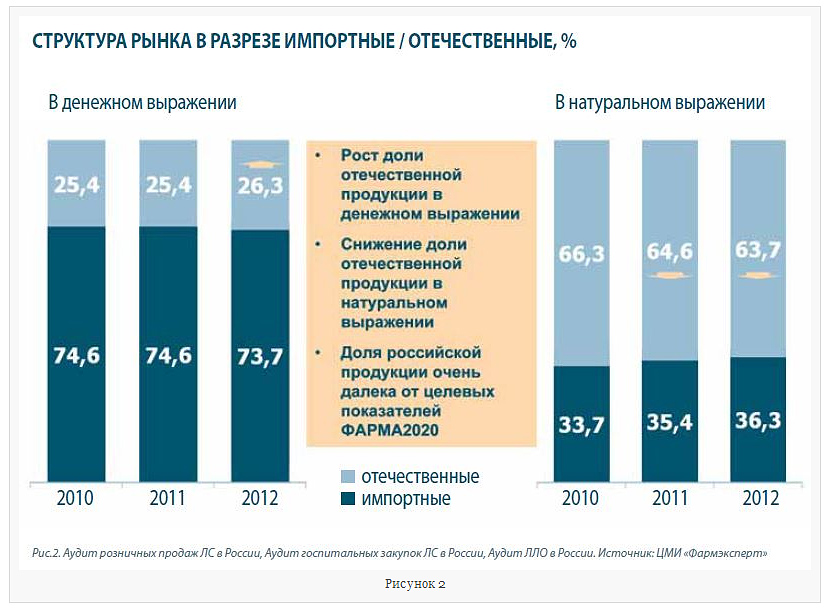 приходится абсолютное большинство продаж – 63,7%, но тут динамика обратная, доля российских компаний сокращается. С рынка вытесняются, как правило, устаревшие, малоэффективные и дешёвые ЛП, тоже самое наблюдается с группой небрендированных дженериков. При этом в сегменте дорогостоящих в т.ч. оригинальных ЛП российские производители имеют, что предложить рынку, но, увы, пока таких примеров не так много, как хотелось бы. Между тем, тенденция эта в ближайшем будущем, очевидно, будет меняться, причём как за счёт эволюционных процессов – вывод на рынок новых оригинальных российских разработок, а так же процессов импортозамещения, так и революционных – запуск и выход на проектную мощность российских предприятий иностранных фармацевтических компаний. Этот путь можно назвать революционным, поскольку производство ЛП на этих предприятиях кардинальным образом изменит структуру рынка, их продукция, если она предполагает производство полного цикла, а не просто упаковку, может считаться российской. Во всяком случае, Правительство РФ озвучивает именно такие предложения.
приходится абсолютное большинство продаж – 63,7%, но тут динамика обратная, доля российских компаний сокращается. С рынка вытесняются, как правило, устаревшие, малоэффективные и дешёвые ЛП, тоже самое наблюдается с группой небрендированных дженериков. При этом в сегменте дорогостоящих в т.ч. оригинальных ЛП российские производители имеют, что предложить рынку, но, увы, пока таких примеров не так много, как хотелось бы. Между тем, тенденция эта в ближайшем будущем, очевидно, будет меняться, причём как за счёт эволюционных процессов – вывод на рынок новых оригинальных российских разработок, а так же процессов импортозамещения, так и революционных – запуск и выход на проектную мощность российских предприятий иностранных фармацевтических компаний. Этот путь можно назвать революционным, поскольку производство ЛП на этих предприятиях кардинальным образом изменит структуру рынка, их продукция, если она предполагает производство полного цикла, а не просто упаковку, может считаться российской. Во всяком случае, Правительство РФ озвучивает именно такие предложения.
Для иностранных компаний получение «российского гражданства» тем более важно в свете т.н. преференций для российских фармацевтических производителей. Они предусматривают предоставление преимущественного права закупать в рамках государственных закупок продукцию российских компаний. Делается это по разным причинам – и как стимул развития российского производства и в качестве меры ограничивающей рост цен на ЛП. Продукция отечественных предприятий чаще всего ощутимо ниже, особенно если это касается дженериков.
«Де-юре», преференции для российских компаний существуют и сейчас – существуют специальные постановления Минэкономразвтия, но фактически они не работают т.к. действие этих постановлений распространяется только на 1 год, при этом постановление вступает в силу лишь в марте-апреле, то есть когда уже большая часть наиболее крупных аукционов разыграна. Тем не менее ситуация может кардинальным образом измениться, в частности в феврале текущего года появилась инициатива Минпромторга, которая предполагала введение запрета закупки на торгах таких иностранных ЛП, для которых зарегистрированы два и более российских аналогов. Предложение носит абсолютно революционный характер и пока его не поддержали ключевые профильные ведомства. Однако, участникам рынка следует учитывать, что эта инициатива может получить своё продолжение. Именно поэтому абсолютное большинство крупных иностранных компаний либо уже имеет собственные производственные мощности в России (например: Гедеон-Рихтер, КРКА, Сервье, Санофи и др.), либо находится на разных стадиях строительства (Новартис, Никомед/Такеда, Берлин-Хеми, Астра-Зенека и т.д.).
Тема GMP для российского рынка значительно моложе вопросов ВТО, но важность её для российского рынка отчасти даже выше. Не вдаваясь в исторические подробности, хочется сказать, что внедрение GMP в России планировалось уже не однажды, при этом столько же раз от него отказывались, перенося на более поздние сроки. Очередным сроком перехода на GMP назначено 1 января 2014 г. и есть все основания полагать, что именно эта дата наконец-то станет рубежом после которого на российский рынок будут допускаться только препараты, произведённые в соответствии с требованиями GMP. Во-первых, соответствующее положение фигурирует в «Законе об обращении лекарственных средств», а закон не имеет обратной силы, во-вторых, необходимость перехода на GMP зафиксирована в стратегии развития российских фармацевтических производителей до 2020 г. (более известная как ФАРМА 2020) и на техническое перевооружение российских фармпредприятий выделены немалые средства. И, в-третьих, подавляющее большинство крупных российских фармпредприятий либо уже готовы к сертификации и даже имеют сертификаты, выданные независимыми агентствами, либо закончат все необходимые процедуры во второй половине текущего года. То есть накопилась некоторая критическая масса компаний, которые произвели модернизацию и теперь им крайне важно, чтобы средства, вложенные в этот процесс, не были потрачены впустую.
Несмотря на это удивляет позиция профильных ведомств, которые пока сделали очень мало для того, чтобы с 2014 г. система могла полноценно заработать. В частности, несмотря на неоднократные обращения участников рынка в лице директоров предприятий и представителей отраслевых общественных организаций, не сформирована система инспектората. Иными словами даже если компания перешла на GMP и даже имеет соответствующий сертификат российского или зарубежного образца, она не может подтвердить его наличие для чиновников. Не просто нет органа, который будет оценивать соответствие условий на предприятии требованиям GMP, пока даже не ясно, кто будет уполномочен принимать существующие сертификаты. Пока время ещё остаётся, но все помнят опыт внедрения некоторых инициатив, которые ставили под угрозу работу целых отраслей – например, печально известная система ЕГАИС. Всем компаниям, занятым системой лекарственного обеспечения в России хотелось бы перейти на работу в новых условиях с наименьшими потерями для бизнеса.
Источник
Вернуться к разделу

 развитых странах, где очень высоким считается показатель прироста в 2-3%.
развитых странах, где очень высоким считается показатель прироста в 2-3%. приходится абсолютное большинство продаж – 63,7%, но тут динамика обратная, доля российских компаний сокращается. С рынка вытесняются, как правило, устаревшие, малоэффективные и дешёвые ЛП, тоже самое наблюдается с группой небрендированных дженериков. При этом в сегменте дорогостоящих в т.ч. оригинальных ЛП российские производители имеют, что предложить рынку, но, увы, пока таких примеров не так много, как хотелось бы. Между тем, тенденция эта в ближайшем будущем, очевидно, будет меняться, причём как за счёт эволюционных процессов – вывод на рынок новых оригинальных российских разработок, а так же процессов импортозамещения, так и революционных – запуск и выход на проектную мощность российских предприятий иностранных фармацевтических компаний. Этот путь можно назвать революционным, поскольку производство ЛП на этих предприятиях кардинальным образом изменит структуру рынка, их продукция, если она предполагает производство полного цикла, а не просто упаковку, может считаться российской. Во всяком случае, Правительство РФ озвучивает именно такие предложения.
приходится абсолютное большинство продаж – 63,7%, но тут динамика обратная, доля российских компаний сокращается. С рынка вытесняются, как правило, устаревшие, малоэффективные и дешёвые ЛП, тоже самое наблюдается с группой небрендированных дженериков. При этом в сегменте дорогостоящих в т.ч. оригинальных ЛП российские производители имеют, что предложить рынку, но, увы, пока таких примеров не так много, как хотелось бы. Между тем, тенденция эта в ближайшем будущем, очевидно, будет меняться, причём как за счёт эволюционных процессов – вывод на рынок новых оригинальных российских разработок, а так же процессов импортозамещения, так и революционных – запуск и выход на проектную мощность российских предприятий иностранных фармацевтических компаний. Этот путь можно назвать революционным, поскольку производство ЛП на этих предприятиях кардинальным образом изменит структуру рынка, их продукция, если она предполагает производство полного цикла, а не просто упаковку, может считаться российской. Во всяком случае, Правительство РФ озвучивает именно такие предложения.
